wonderzero2 wrote:
一般人是看不懂的,我只想知道
冠狀病毒 距離 流感化 還要多久時間。
事實上是, 早就已經是流感化了
我們過去的經驗是 , 得過這個病毒一次之後 , 例如天花(人痘病毒) , 就不會再一次得到這個病 。
這稱為 "immune"免疫的這個字《源自拉丁文「無義務的immunis」“exempt from public service.”的意思》是指對有害物質或發病過程,特別是對病原體或傳染病不具敏感性或具有抵抗力的狀態。
對免疫概念的第一個書面描述可能是由雅典人希波克拉底Hippocrates of Kos提出的,在西方被公認為「醫學之父」的他在公元前 430 年描述了當瘟疫襲擊雅典時:「病人和垂死的人受到了那些曾經遭受過瘟疫後而康復了的人之同情與照顧。,因為他們知道疾病的進程並且自己沒有憂慮。因為沒有人會受到第二次攻擊,或者說沒有造成致命的結果」
流感化 的意思 是每年都會再流行一次的意思
但是"新冠"這個病是會重複不斷的的得到 , 不但不可能是免於第二次攻擊, 還會3次,4次以上一再罹病
但是兩者原因是不同的, 前面已經解釋了, 不能混為一談
wonderzero2 wrote:
根據 病毒要生存 理論(假說?)
A,越容易使人致死的病毒 等於 病毒要滅絕。(如果沒有抑制AIDS藥物的話)故推得AIDS 病毒 要滅絕,,人會死於 免疫力低。
AIDS潛伏期可長達10至15年, 病毒有太多的機會, 太長的時間能複製自己而不會造成宿主死亡
並不能這樣舉例 , AIDS 是攻擊 CD4+ 細胞(帶有CD4+ T分子的T淋巴細胞) , 會喪失免疫力 ,削弱免疫系統及其自行修復損傷的能力。
當CD4 <200 Cells/mm3,免疫系統的力量已微弱到無法 對抗各種伺機性感染而發病〈例如口腔食道念珠菌感染、肺結核菌、肺囊蟲肺炎、卡波西氏肉瘤、隱球菌性腦膜炎、巨細胞病毒感染…等〉
所以死因是歸因於其它的併發症 , 而不是直接死於AIDS的感染
wonderzero2 wrote:
B越容易使人感染的病毒 等於 人體共存
並不存在這種推論 , 兩者無關
wonderzero2 wrote:
結合A和B 我們得出 未來AIDS病毒會與人體共存,但現實是 要吃藥抑制AIDS病毒
A和B 在AIDS這個病都是不存在的
建議您先了解 免疫 這個字 的意思
免疫 是對這個病不敏感了或是有抵抗力了
要有免疫力, 對於傳染病是先要有"免疫記憶" , 記住這個病毒長怎樣 , 才能去補捉它
所以是打過疫苗或感染過這個病毒 , 記住這個病毒了,有免疫記憶了 , 能認出這個病毒了, 對這個病不敏感有抵抗力 , 當然就能 與病毒共存
而且和 "共存" 相對的是 採取隔離isolation 或 撿疫 Quarantine
這和 AIDS 的致病機制? 並不能混為一談
wonderzero2 wrote:
現在把 抑制藥改為 疫苗,AIDS病毒改為covid 19 代入,每次投藥AIDS病毒都會變異一次,經過這麼多年了 ,想必AIDS病毒已經學會如何跟人類共存再也不需投入抑制藥,但與事實相反。
請先了解前題是 AIDS 是攻擊 CD4+ 細胞(帶有CD4+ T分子的T淋巴細胞) 造成喪失免疫 , 並不是因為病毒變異, 變臉了造成沒有免疫記憶 , 這完全是兩回不同的事
無法代入
再者,抗愛滋病病毒藥物治療是透過不同的藥物,襲擊處於生長期不同階段的病毒,採雞尾酒療法來抑止病毒的複製。
混合+組合的治療是最有效的療法,例如包括兩種核苷逆轉錄酶抑制劑加上一種蛋白酶抑制劑。
完全不是, 也不存在 《想必AIDS病毒已經學會如何跟人類共存再也不需投入抑制藥》?
wonderzero2 wrote:
第一輪 初代covid 問世,6個月後 疫苗問世,如今經過2年時間 ,
第N輪 JN1 ,台灣疫苗 XXB1.5
然後呢 ? 這個病毒 和它的親戚病毒之間 , 是存在"交叉免疫保護"
所謂 交叉免疫保護是存在"免疫記憶" ,這種記憶是 記住了 其中一種 , 能舉一反三, 當其它相似病毒侵入時, 也會被認出來而加以補追
發現存在其它冠狀病毒的交叉免疫保護
(1)過去得過其它親戚人類舊冠狀病毒 OC43, NL63的人, 能免於新冠重症
和疫苗一樣, 接觸"舊冠"同樣是預先記憶了"抗原" , 能以"舊冠"辨識出新冠病毒
血清陽性率研究表明,最常見的人類舊冠是 OC43,其次是 NL63、HKU1,最後是 229E。
許多未感染過新冠病毒, 也沒打過疫苗的人,體內卻早已存在對抗新冠病毒SARS-CoV-2的交叉反應抗體
美國曾經收集2019大流行前的血液樣本, 發現在這個病大流行前的血清, 已經找到對 SARS-CoV-2 有交叉反應的抗體。
而且由醫院輕症和重症病房的統計得知 , 有 OC43/ NL63 抗體的病人, 大多是輕症 , 重症病人大多沒有親戚冠狀病毒的抗體。
推測這是之前感染類似普通感冒OC43,NL63、HKU1等輕微症狀冠狀病毒親戚 ,如同牛痘對人痘(天花)有交叉免疫保護 , 先前其它種類的冠狀病毒感染對 SARS-CoV-2這個親戚也產生了交叉免疫反應。
(2)18年前高雄長庚一名得了SARS倖存醫護, 抗體效價比沒有SARS感染的員工,接種1劑抗體效價提高了68倍, 7名 SARS康復者抗體比一般人高出8.5倍, 代表SARS康復者有持久性長達18年的交叉「免疫記憶」
基於
(1)有交叉免疫保護
(2)長達10多年持久性免疫記憶 ,
並不需要一變種就換疫苗? 事實業證明以舊病毒為藍本的舊疫苗 , 對於變重病毒仍然存在保護力
這個病影響死亡最大因素是「年齡」
65歲以上佔死亡人數的9成以上
年輕人佔不到一成
有無「免疫記憶」才是原因
是記不住就只好再補強多打
wonderzero2 wrote:
換我開始想要不要補打疫苗,根據疫苗原理 打下去 只保護半年。
傳統上 , 補打疫苗 稱為 booster , 打幾次 ? 其依據的標準稱為抗體效(力)價
抗體效(力)價 要高於 病毒的毒力 , 才有保護力
這是一個小偷要多少警察去抓的問題 , 派一個警察抓不到 , 再多派
或是筆試60分要上幾堂課的問題 , 上一次課記不住 , 於是同樣的課再次補習, 再上一次
有些人考駕照不必上課自己讀, 有人上一次就記住了
有些人考駕照上了三次課還是無法舉一反三, 只要題型改變就答不出來
只好再去上課
所以, 這不是疫苗原理 , 而是接受疫苗的個體 , 其免疫記憶記住能維持多久 的 個體問題
依據 18年前高雄長庚一名得了SARS倖存醫護, 抗體效價比沒有SARS感染的員工,接種1劑抗體效價提高了68倍, 7名 SARS康復者抗體比一般人高出8.5倍 的這個結果可知 , 代表SARS康復者對 SARS-2 有持久性長達18年的交叉「免疫記憶」
wonderzero2 wrote:
在根據 YT醫生 說每年打流感,就算你 沒猜中,萬一不幸中流感 症狀不會很嚴重
問題是 冠狀病毒 不等於 流感化,初代疫苗 理論上保護力為0 ,如果不幸中JN1 死狀率到底是多少
就完全不是 拿 流感 的模式 來推論 冠狀病毒 也同樣就是這樣 ?
這個病毒不一樣! 在S蛋白RBD區遠端被改造帶正電荷能靜電吸附
H,K,R三種氨基酸 帶正電荷
這一群帶正電氨基酸 K444 R509 R346 , R355 K356 R357 R466 , 在目前的流行株Omicron不但沒有改變,還增加到9個位點帶正電, 和之前的Alpha,Delta一樣,完全能 "靜電吸附", 能以"氣溶膠"黏上來 , 而不需經"ACE2受體"這個門戶相嵌合,能躲過抗體綑綁

就算抗體綑綁了S蛋白,防止嵌合上受體ACE2,病毒照樣能以靜電吸附黏上帶負電的HSPGs。

這個病毒因為能靜電吸附造成打疫苗能 "突破性感染" , 自然感染後還會再次感染
病毒能逃避抗體 , 超出人體免疫系統當中,液遞免疫原本的功能

病毒仍然能侵入此80%打過疫苗或自然感染過的族群 , 在T細胞清除之前,也會再度放出病毒!
群體免疫herd immunity 當然不存在 !
這一篇是美國醫學期刊 JAMA , 打過四劑BNT照樣突破性感染!
該篇論文統計實驗是在以色列做的, 打過三劑BNT之後的突破性感染是19.8% , 打第四劑是降低到 6.9%
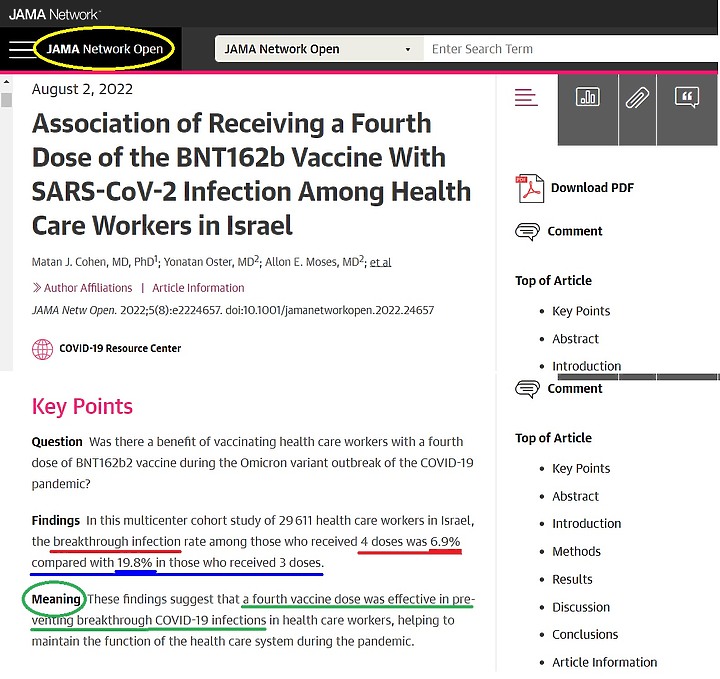
打四劑疫苗會「"突破性感染"」? 好, 歸咎於疫苗無效不打? 自然感染3次4次, 恢復之後還會再次感染?
因為, 液遞免疫, 釋放到細胞外液的『抗體』會被逃脫 , 當然病毒能一次又一次侵入到細胞內 ,所以病毒一定會突破人體阻絕境外的抗體, 一定會跑進來 , 造成感染數目一定會很高
但是打過疫苗後碰上感染之後會如何 ?
台灣的數字顯示被感染後,99.56%人不會轉重症肺炎 , 是無症狀或輕症
我們的免疫系統有二大部份 , 液遞出去的抗體能中和病毒←這是阻絕境外 , 現在病毒逃過抗體跑進來, 這些漏網之魚有第二道防線"T細胞免疫"在感染後清除病毒
所以99.56%人才會是 無症狀或輕症
雖然這個病毒 能逃脫抗體綑綁, 有抗體照樣帶電黏上來, 當然就會侵入人體, 造成高感染數
然而, T細胞對於病毒的辨識不同於抗體; 抗體是嵌合S蛋白,捆綁住整個S蛋白防止和ACE2受體接合(嵌合)。但T細胞則是將S蛋白分解為一個一個小單位來辨認。

這些病毒蛋白質(抗原) , 是經由抗原呈遞細胞(antigen-presenting cell、APC)包括 巨噬細胞、B細胞及樹突狀細胞,是將病毒蛋白分解成蛋白片段較小的肽(胜肽)。
胞吞 → 分解(蛋白片段較小的肽)→添加MHC2組成複合體 →抗原呈遞
T細胞不是認整個S棘蛋白, 而是拆解為較小的"胜肽"認出病毒
打比方如同認人不是認 整個臉 , 而是拆開成 眉毛 眼睛 鼻子 耳朵來認 , 例如蠟筆小新以"一字眉"被認出來, 人臉是以鳳眼, 朝天鼻 ,招風耳 的形式被認來是"那個人"
MHC II(主要組織相容性複合體 II)是免疫細胞添加上去的記號, 代表這個Ag抗原曾經被APC細胞吞噬過(如同罪犯被逮補過), 這個『蛋白』屬於是侵入的病原所有, 加上記號是記憶分類其為"致病病源", 避免誤判類似的蛋白。
反之,這個蛋白若未被APC吞過(沒打過疫苗或之前沒感染過舊冠),沒有添加MHC II這個記號, 會被視為"良民",不是只有抗體逃脫, 帶有這個蛋白的病毒也不會被辨識出來,是連T細胞都不會啟動,病毒就長驅直入了 。
雖然病毒變種了,但是所蛋白片段較小的"胜肽"並沒有改變 , 仍然會被T細胞認出來
雖然無法擋住病毒侵入, Omicron和之前的Alpha,Delta病毒一樣"突破性感染",能被驗到PCR陽性,但是免疫系統不是只有"液遞" , 還有細胞免疫 , 疫苗 仍然事先讓T細胞產生了免疫, 做感染後的病毒清除 。

左邊"抗體"逃脫 , 但是右邊的T細胞能清除病毒
發現存在其它冠狀病毒的交叉免疫保護
(1)過去得過其它親戚人類舊冠狀病毒 OC43, NL63的人, 能免於新冠重症
和疫苗一樣, 接觸"舊冠"同樣是預先記憶了"抗原" , 能以"舊冠"辨識出新冠病毒
血清陽性率研究表明,最常見的人類舊冠是 OC43,其次是 NL63、HKU1,最後是 229E。
許多未感染過新冠病毒, 也沒打過疫苗的人,體內卻早已存在對抗新冠病毒SARS-CoV-2的交叉反應抗體
美國曾經收集2019大流行前的血液樣本, 發現在這個病大流行前的血清, 已經找到對 SARS-CoV-2 有交叉反應的抗體。
而且由醫院輕症和重症病房的統計得知 , 有 OC43/ NL63 抗體的病人, 大多是輕症 , 重症病人大多沒有親戚冠狀病毒的抗體。
推測這是之前感染類似普通感冒OC43,NL63、HKU1等輕微症狀冠狀病毒親戚 ,如同牛痘對人痘(天花)有交叉免疫保護 , 先前其它種類的冠狀病毒感染對 SARS-CoV-2這個親戚也產生了交叉免疫反應。
(2)18年前高雄長庚一名得了SARS倖存醫護, 抗體效價比沒有SARS感染的員工,接種1劑抗體效價提高了68倍, 7名 SARS康復者抗體比一般人高出8.5倍, 代表SARS康復者有持久性「免疫記憶」
影響死亡最大因素是「年齡」
65歲以上佔死亡人數的9成以上
年輕人佔不到一成
死亡率 的分母是 罹病病例數 , 分子是 罹病死亡數
死亡率會增加 , 在分子是因為死亡數增加 , 但是65+以上是高危險群 , 增加的病例若是65+以上, 死亡率上升機率高,若增加的病例是年輕人, 因為死亡率低,一旦罹病放入數據當中,不增加分子,反而可以放大分母,拉低死亡率
減少65+以上的病例 , 或65+以上雖然罹病,但能對抗病毒,就能降低死亡率
2年前大流行期,2022年時,死亡率最低的紐西蘭, 65+以上長者的疫苗接種率接近 100%
比台灣低的南韓 , 60歲以上. 疫苗接種率89.8%接近 90%

新加坡第1-2劑 , 60-69歲完整接種疫苗達90% , 70歲以上達84%
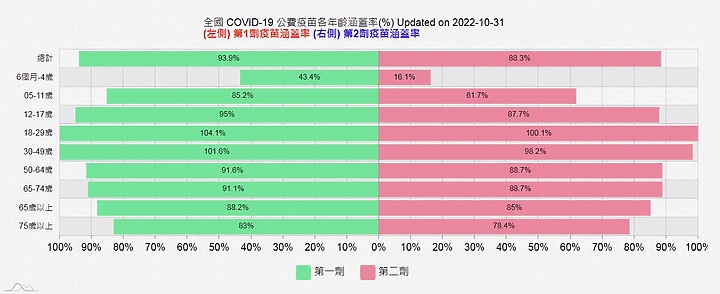
台灣長者的疫苗接種率比不上這些國家,65歲以上1,2劑都還不到90%, 加強劑在65+以上只有77% ,75歲以上只有69%
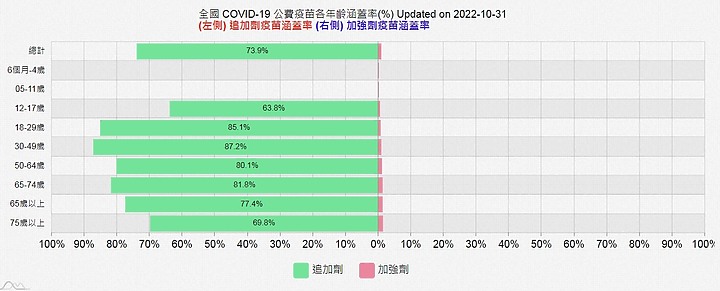
但是台灣年輕人1,2劑打超過 100%,第三劑注射也比65+長者高 , 但年輕人死亡率本就低 , 不如 65歲以上高危險群對於死亡率的效應
65+以上長者的疫苗接種率, 是左右"死亡率"的最大因素
死亡率最低的紐西蘭, 65+以上長者的疫苗接種率接近 100%
紐西蘭 當時2021年11月9日 的抗議動作非常大,紐西蘭也是花了很多功夫才拉高老年人注射率
這有二篇報告, 第一篇 說明隨著時間推移降低保護, 感染風險增加,但不是降到0
Protection against SARS-CoV-2 after Covid-19 Vaccination and Previous Infection
March 31, 2022
新英格蘭醫學期刊N Engl J Med 2022; 386:1207-1220
DOI: 10.1056/NEJMoa2118691
並非天然感染過就穩了? 這個病毒帶正電荷能靜電吸附, 沒打疫苗但天然感染後會再次感染
如統計,未打疫苗再次感染的風險是 2.25 VS 打1劑疫苗突破性感染風險 0.43
打2劑疫苗突破性感染風險降到0.40
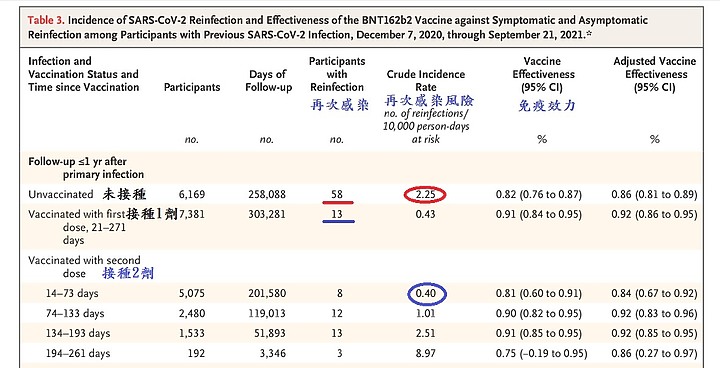
隨著時間推移 , 抗體效價會降 ,T細胞記憶也需要被喚醒
接種二劑
14-73天 , 感染風險 0.40
74-133天,感染風險 1.01
134-193天,感染風險 2.51
194-262天,感染風險 8.97
是隨時間而風險增加 0.4 → 8.97
兩劑 BNT162b2 疫苗與針對 SARS-CoV-2 感染的高度短期保護有關;這種保護在 6 個月後顯著減弱。感染後 1 年多,通過接種疫苗增強的感染獲得性免疫力仍然很高。(由英國衛生安全局和其他機構資助;ISRCTN 註冊號,ISRCTN11041050. .)
1年之後,未打疫苗再次感染的風險是 2.40 VS 打1劑疫苗突破性感染風險 0.52
1年後打2劑疫苗突破性感染風險降更多0.09 , 差距拉的更大 , 打疫苗的保護較有持久性

接種二劑 一年之後的追蹤
14-73天 , 感染風險 0.09
74-133天,感染風險 0.34
134-193天,感染風險 1.31
194-262天,感染風險 1.27
但是
下降在194天之後, 6個月之後,是下降,但下降會停滯在低原期1.31→1.27 , 風險還是比未打疫苗2.25來的低
並不會一直降下去降到沒有! 或為未打疫苗2.25 ? 不會
再看第二篇 , 會被突破性感染! 但是感染後會不會轉重症肺炎呢?
Original Investigation
November 4, 2021
Association Between mRNA Vaccination and COVID-19 Hospitalization and Disease Severity
美國醫學期刊JAMA. 2021;326(20):2043-2054. doi:10.1001/jama.2021.19499
這一篇是調查 住院後重症死亡的風險
病程發展為死亡或需要加上呼吸器, 打疫苗是 12.0% , 未打疫苗風險增加一倍是24.7%
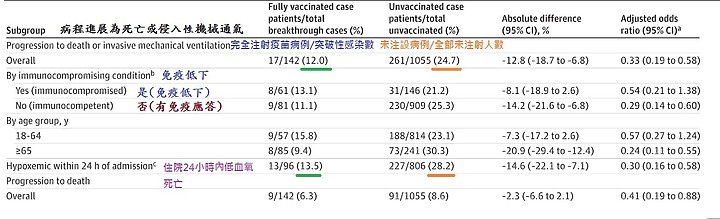
住院24小時內低血氧死亡的風險 打疫苗是 13.5% , 未打疫苗風險增加一倍是28.2%
再看有注射疫苗那一欄 , 在突破性感染上 , 因年齡而重症反而不顯著(18-64歲 9/57:15.8) VS ( 65+歲8/85:9.4)
是反過來 65+歲反而低
也就是打過疫苗反而能扭轉 (65+歲年齡高風險) 這項因素
因為對照,未打疫苗那一組 (18-64歲 188/814:23.1) VS ( 65+歲73/241:30.3) , 65+歲風險就變高了
住院後24小時內因低血氧而死亡 , (打疫苗13/96:13.5) VS (未打疫苗227/806:28.2) ,未打疫苗高出一倍
由於這個病的年輕人死亡率低 , 並非整體死亡率的影響因子,但是 65歲以上是高危險群,只要65歲死亡率能控制,死亡率就會降下來!全球死亡率最低的紐西蘭,其65歲以上老人的疫苗接種接近100%,老年人接種疫苗覆蓋率高就能壓低整體死亡率
冠狀病毒都沒有長期抗體!6個月後抗體會降下來, 抗體降下來並不代表完全沒有 "免疫記憶"
也不代表下一道防線 T 細胞免疫 就會因此不存在
問題是這個病毒本來就能逃脫抗體,是入侵後才由T細胞清除,65歲免疫記憶衰退,打疫苗喚醒T細胞有記憶,老年人能在病毒入侵時清除, 整體死亡率就能降下來
要看年齡 !





























































































