- 2003年的SARS就是冠狀病毒,對岸在03年爆發過疫情,此後研究冠狀病毒來龍去脈很奇怪嗎?用這種東西當證據只是在向大家展示你有多好騙。
- 如果你還有點求知慾,建議看看這影片:
歐洲議會新冠肺炎峰會爆料美國制造SARS和新冠實錘!!!馬丁博士
當然如果你腦袋中充滿「美國是對的、民進黨是對的、老共是邪惡的」這種固執念頭,那就別看了...住在井內也挺好你說是吧。
米國因此病毒死了超過100萬人,如果真是老共放的,你以為就米國的性子能不來個超大動作?
米國為何在新冠爆發前陣子就搞個病毒爆發演習呢,難道有人穿越?
病毒溯源到迪特里克堡實驗室怎就無法繼續下去呢?
說白了,目前全球也只有米國有製造病毒的技術,其他國家還沒有。
塔綠斑網軍頭子已成淡水河浮屍,各位綠網軍繼續助紂為虐不怕成下一位?
美國國家衛生研究院(NIH) 2021年6月15日發布: NIH發現在美國早期感染 SARS-CoV-2的新證據。
根據美國國家衛生研究院的收集的樣本,發現五個州SARS-CoV-2 感染的證據比最初報導的要早。SARS-CoV-2 早在 2019 年 12 月就存在於美國。這些發現目前發表《臨床傳染病》雜誌上。
https://www.nih.gov/news-events/news-releases/nih-study-offers-new-evidence-early-sars-cov-2-infections-us
-
註:SARS-CoV-2 是國際病毒分類學會對新冠肺炎病毒的正式稱呼(WHO則命名為2019-nCoV)
美國國立衛生研究院(NIH)的一項新研究顯示,早在2019年12月,美國數州已出現新冠病毒,並進行低水平傳播。這比目前官方報告的第一例新冠確診病例(2020年1月)要早數周。
周二(6月15日)美國國立衛生研究院在《臨牀傳染病》上發表的論文顯示,在美國五個州(伊利諾伊州、馬薩諸塞州、密西西比州、賓夕法尼亞州和威斯康星州)發現更早的新冠病毒感染的證據。
https://www.bbc.com/zhongwen/trad/science-57498207
菲律賓學者:2019年11月,美軍就曾告知以色列“中國會暴發疾病”,美國是如何知道的?
https://www.facebook.com/TongShuoHK2.0/posts/364623425136896/
CommonwealthB wrote:
2016年曾發現SARS近親病毒卻未示警
「泰晤士報」10日報導,武漢病毒研究所早已著手尋找2003年SARS(嚴重急性呼吸道症候群)病毒的源頭,吸引美國透過紐約一個慈善機構挹注資金,美國頂尖冠狀病毒科學家還分享了先進的病毒操縱(virus manipulation)技術。
然而武漢病毒研究所從中國南方蝙蝠洞裡蒐集到冠狀病毒後,對病毒所作的實驗風險愈來愈大。一開始,所方還會公開研究結果,並主張這類工作有助於疫苗開發,為實驗相關風險辯護。
但2016年事件有了變化。研究人員在雲南省墨江一處礦井中,發現一種新型冠狀病毒,當地有些人死於跟SARS類似的症狀。
中國當局未對全球示警,沒通報這些死亡事件。如今這種病毒被認為是目前已知在疫情爆發前就存在的COVID-19唯一近親。
墨江發現的病毒被送往武漢病毒研究所,所內科學家的研究成果成為機密。一名美國調查人員說:「報告檔案開始變不透明。機密計畫就是從此刻展開。」
美國國務院調查人員在報告中寫道:「儘管武漢病毒研究所自稱是非軍方機構,美國確信該研究所曾跟中國軍方合作發表和進行秘密計畫。武漢病毒研究所至少從2017年起就代表中國軍方涉入機密研究,包括實驗室動物實驗。」
美國參議院報告稱,中國軍方也被授予武漢病毒研究所內的主管職位。
根據美國調查人員,中方的機密計畫是要讓礦井內發現的病毒對人類更具傳染力。
中方2017年開始祕密研究讓新病毒更具傳染力
調查人員相信這項計畫導致COVID-19病毒產生,並在一場實驗室事故後外流到武漢市內。一名調查人員說:「情況愈來愈清楚顯示,武漢病毒研究所涉及製造、傳播和隱匿COVID-19大流行。」
美方人員發現證據,證明2019年11月有從事相關實驗的研究人員被送進醫院時,身上出現類似COVID-19的症狀,其中一名研究人員的家屬死亡。一個月後,武漢得知疫情存在。
一名調查人員說:「我們非常有信心這可能就是COVID-19,因為他們在實驗室中從事尖端冠狀病毒研究,他們是受過訓練的生物學家,年紀30、40多歲,35歲的科學家染上流感不會病得很重。」
另一項分析則顯示,最初的疫源中心靠近武漢病毒研究所的實驗室,而非一直以來大家認為的華南海鮮市場。
美方調查人員也說明自己如何掌握證據,顯示武漢病毒研究所在疫情爆發前就在研發疫苗。
相關消息人士透露:「我訪問了跟武漢病毒研究所關係密切的亞洲科學家。他們跟我說,他們相信2019年秋天就有跟COVID-19相關的疫苗研究在進行。」
泰晤士報指出,解放軍自己的疫苗專家周育森(Zhou Yusen)曾跟武漢科學家合作研究MERS(中東呼吸症候群)冠狀病毒,在疫情當下也在跟武漢科學家合作。
周育森遭到懷疑,是因為他在2020年2月就申請COVID-19疫苗專利,距離中國對世界承認爆發疫情才過了一個多月。
疫情爆發後周育森迅速申請疫苗專利卻突墜樓亡
今年4月,負責美國疫苗研發計畫的凱雷克(Robert Kadlec)發表一份與人合著的報告,認定周育森的團隊研發疫苗時間應該不晚於2019年11月,當時疫情才剛開始。
周育森似已於2020年5月死亡,享年54歲,中國媒體曾提及他過世,一份研究報告在他的名字後面括號加註已歿字樣。目擊者告訴美國調查人員,周育森是從武漢病毒研究所屋頂跌落,但此說未經證實。
泰晤士報指出,如果某個國家能夠讓國民接種疫苗,對抗自己的機密病毒,可能就握有能夠扭轉世界權力平衡的武器。
一名美國調查人員說:「我的看法是,墨江事件被隱匿是因為軍事機密,跟(共軍)追求病毒生物武器和疫苗的軍民兩用能力有關。」
"墨江病例"應該不是 2016 年 , 2016 年是事後發表論文的日期
對於這個群聚感染 , 2016年"武漢病毒實驗室" 葛興義Ge等人 發表了報告
https://link.springer.com/article/10.1007/s12250-016-3713-9
Virologica Sinica volume 31, pages31–40(2016)
Coexistence of multiple coronaviruses in several bat colonies in an abandoned mines
多種冠狀病毒在廢棄礦井的數個蝙蝠群落中共存
Zheng-Li Shi 石正麗也是共同作者

文章提及
我們發現礦井中不同蝙蝠物種中的多種冠狀病毒高頻率感染。測序的RdRp(RNA-dependent RNA polymerase gene)部分片段與特徵明確的阿爾法冠狀病毒具有80%–99%的核酸序列同一性物種,包括BtCoV HKU2,BtCoV HKU8和BtCoV1,以及未分配的物種BtCoV HKU7和BtCoV HKU10。此外,監視還發現了兩種未分類的β冠狀病毒,一種是SARS樣冠狀病毒的新菌株,另一種是潛在的新型β冠狀病毒。此外,在所有六個蝙蝠物種中均檢測到冠狀病毒感染,這種現象促進了重組並促進了新型病毒株的出現。
在他們的發現中發現了兩種未分類的β(乙型)冠狀病毒,其中一種是RaTG13(當時稱為BtCoV / 4991)。在冠狀病毒世界中,β冠狀病毒很特別,因為SARS和MERS都是β冠狀病毒,在所有冠狀病毒中最致命。
因此,它們被認為具有特殊的大流行潛力,因為Shi(石)實驗室出版物的結論句暗示RaTG13 指明:“應特別注意這些冠狀病毒譜系”(Ge等,2016年)。
然而, "墨江病例"更早在之前的2012年 , 雲南墨江就有六名礦工, 就因為感染了未知病毒造成白肺, 被送到昆明醫科大學,負責的醫師李旭還撰寫碩士論文, 有整本的碩士論文! 對照病理現象完全和2019年的SARS-2相同
事後批漏的論文顯示, 這個未知病毒是目前病毒基因庫當中 , SARS-2病毒的最近親屬
這個最近親戚 RaTG13 (之前稱BtCoV / 4991)
是 石正麗 發表在《Nature》 volume 579, pages270–273 (2020)的論文自己說的
這件事是早在早在兩年前就批漏, 只是主流媒體都沒有刊登
雲南昆明醫科大學 發表的碩士論文《未知病毒引起重症肺炎6例分析》,封面日期是2013年5月
https://www.mobile01.com/topicdetail.php?f=780&t=6371784&p=7#81995615

當時(2012年)負責治療生病礦工的醫師李旭曾多次諮詢其他中國專家意見,並用上呼吸器、抗凝血劑、類固醇及抗生素等治療,並說在中國抗疫專家鍾南山的監督之下,礦工們接受肝炎、登革熱及愛滋病毒檢測,之後相關單位把染病礦工的組織樣本送往武漢病毒研究所,確定是一種類似SARS的冠狀病毒,而李旭也撰寫論文研究。

而當時那個同樣會造成"白肺"的未知病毒, 病徵和7年後的武漢病毒是一樣的!
對比一下 李文亮醫師 傳出得簡訊 圖片

發出的簡訊 atypical pneumonia cases "非典"
下圖為7年前 李旭論文當中的 胸部X光及 CT
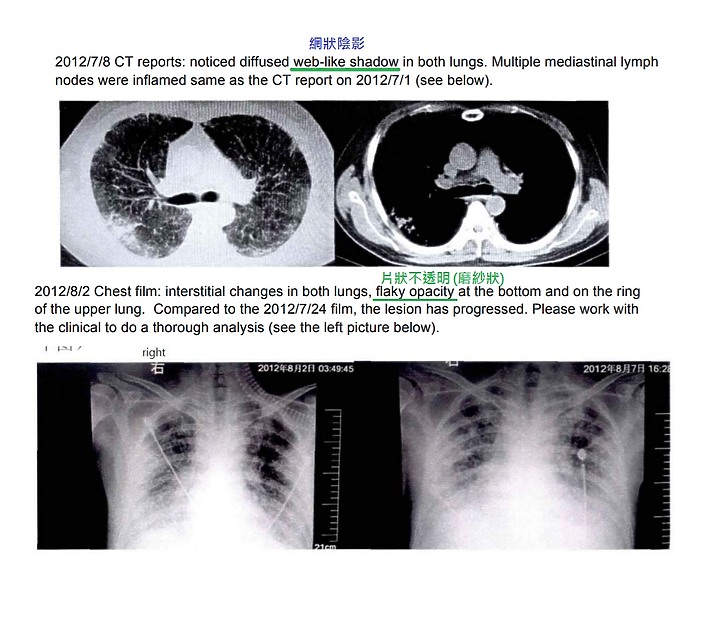
是不是一模一樣
這個不能稱為武漢病毒的新冠病毒SARS-CoV-2病毒 ,有5個奇怪特徵, 很難以自然演化或突變來解釋
更為神奇的是 ,這個病毒
(1)SARS-CoV-2有獨特的Furin弗林蛋白酶裂解位點

問題是基因序列有 96%相同的 RaTG13 , 身為SARS-CoV-2最近的親戚及其它冠狀病毒, 卻都沒有 "弗林蛋白酶" ? 與它的近親相比,SARS-CoV-2這個弗林蛋白酶位點對是全新的
那麼 , 沒有 荷蘭人的紅髮基因 ? 沒有來自泉州大食(色目人,眼睛有顏色)祖先 , 卻生出紅棕髮藍綠眼的小孩?基因從那裏來的? 辯稱這沒有婚外情? 沒有人工生殖? 都推給是突變嗎 ?
一般的突變, 不一定是有意義的, 有時只是亂碼 , 但這個 RBD 區 被插入的 PRRA 是有意義的 ,這個 PRRA 的插入 , 能夠引進一種 furin 弗林蛋白酶的內切酶
一次突變 12個鹼基 ? 而且插入在特定位置上,讓 刺突蛋白的S1和S2亞基, 在正確的位置被裂解開 ? 這四個 PRRA 氨基酸 同時發生自然突變 ? 機率有多高 ? 10億分之一
除了突變, 另外能解釋的可能,這個 Furin弗林蛋白酶 是和其它病毒交換而來, 當兩種病毒碰巧侵入同一個細胞時,它們的後代與屬於另一個的 RNA 片段組裝在一起。β-冠狀病毒只會與其他β-冠狀病毒結合,但可以通過重組獲得集體基因組庫中幾乎所有存在的遺傳元素。他們無法獲得基因庫中沒有的元素。問題是, 並沒有已知的 SARS 相關 β 冠狀病毒(SARS2 所屬的類別)具有弗林蛋白酶裂解位點。 那麼 這個Furin弗林蛋白酶是從那裏憑空交換而來?
(2)密碼子問題
SARS-2 弗林蛋白酶裂解位點的被插入的"密碼子" , 是進一步縮小了自然出現起源的可能。
眾所周知(或者至少可以從高中生物回憶起),遺傳密碼使用三個 DNA 單位來指定蛋白質鏈的每個氨基酸單位。當以 3 組為一組閱讀時,4 種不同的 DNA 可以指定 4 x 4 x 4 或 64 個不同的三聯體,或稱為密碼子。由於只有 20 種氨基酸,因此有足夠多的密碼子可供使用,因此某些氨基酸可以由多個密碼子指定。例如,氨基酸精氨酸可以由六個密碼子 CGU、CGC、CGA、CGG、AGA 或 AGG 中的任何一個命名,其中 A、U、G 和 C 代表 RNA 中四種不同的單位。

不同的生物有不同的密碼子偏好。人類細胞喜歡用密碼子 CGT、CGC 或 CGG 指定精氨酸。但 CGG 是冠狀病毒最不受歡迎的精氨酸密碼子,只佔了5% 。
現在,功能性的原因使得 SARS2 具有弗林蛋白酶裂解位點 ,而其表親病毒卻沒有(在電腦資料中)。將其基因組中近 30,000 個核苷酸的基因組與其表親冠狀病毒的基因組對齊來比較。迄今為止已知的最接近的是一種叫做 RaTG13。與 RaTG13 相比,SARS2 在 S1/S2 連接處有一個 12 個核苷酸的插入片段。插入序列是 T-CCT-CGG-CGG-GC。CCT 編碼脯氨酸,兩個 CGG 編碼兩個精氨酸,GC 是編碼丙氨酸的 GCA 密碼子的開頭。
這個插入片段有幾個奇怪的特徵,但最奇怪的是兩個並排的 CGG 密碼子。SARS2的精氨酸密碼子中只有5%是CGG,在其他任何β冠狀病毒中都沒有發現雙密碼子CGG-CGG。那麼SARS2是如何獲得一對受人類細胞青睞但不受冠狀病毒青睞的精氨酸密碼子呢?
(3)原始SARS2棘蛋白上多出6個胺基酸,其中4個都帶有正電, 來的演化株帶更多正電荷
武漢冠狀病毒的棘蛋白上有4種並列的胺基酸且都帶有正電,這使得病毒能夠牢牢『靜電吸附』吸附於人體細胞帶負電的部分,抗體並無法中和靜電吸附 ,造成病毒不需要"受體"就能黏上人類細胞 , 為此還新創了一個『氣溶膠』的名詞 ; 這是新冠病毒傳播能力特別驚人的原因。
『靜電吸附』才能解釋SARS-2為何能額外結合非ACE2受體的細胞,例如攻擊味覺的苦/甜特異性受體/輔助受體 , 造成失去味覺。
由於帶正電的胺基酸會互相排斥,如同磁鐵正極放在一起會彈開, 因此自然界中連3個排成一列的狀況很少見,更何況新冠病毒有4個並排,是絕無僅有。
怒駁扯上高端 王必勝:不是不買BA.5疫苗!現在除美國沒人買得到
https://www.mobile01.com/topicdetail.php?f=814&t=6658773&p=2#85784367
那一個位點帶電, 能量為多少?能吸引到相對於人類細胞那一個受體位置, 每一篇都有資料
這個病毒的S蛋白帶正電荷 , 因此逃脫抗體綑綁
這個病毒 在S蛋白RBD區遠端帶有正電荷群, 能『靜電吸附』
這一群帶正電氨基酸 K444 R509 R346 , R355 K356 R357 R466 , 在目前的流行株Omicron不但沒有改變,還增加到9個位點帶正電, 和之前的Alpha,Delta一樣,完全能 "靜電吸附", 能以"氣溶膠"黏上來 , 而不需經"ACE2受體"這個門戶相嵌合,能躲過抗體綑綁。

如圖K444 R509 R346 , R355 K356 R357 R466(綠色) 這幾個帶正電荷位點, 不是在接合ACE2(紫色)的位置上, 而是位於遠端 , 就算就算綁住了S蛋白RBD去嵌合ACE2 ,這個遠端還能有"額外"的"靜電吸附"力
有三種帶正電荷的氨基酸 , 分別是 別為組胺酸H(Histidine)、離胺酸K(Lysine)和精胺酸R(Arginine)
比較18年前的 SARS-1 和 帶正電荷的SARS-2 在RBD區,帶電位點的氨基酸排列

紅框是對正電荷有影響的位點,和 SARS-CoV-1 帶電相比,SARS-CoV-2 有增強的正電荷群(圖H 藍紫色顯示帶正電荷,紅色顯示帶負電荷) , 相對之下, SARS-1 的S蛋白上藍紫色區分散而且少。

這一群帶正電氨基酸 K444 R509 R346 , R355 K356 R357 R466 和肝素的結合數 及 使用分子操作環境 (MOE) 軟體評估肝素-蛋白質接觸和能量貢獻表明, 與帶正電荷的氨基酸 R346、R355、K444、R466 和可能的 R509 有很強的相互作用。 其所貢獻的能量 如圖示
帶電會如何?
『抗體』就算綁住了S蛋白去嵌合ACE2 , 但這遠端還是能"黏"上帶負電的HSPGs ,造成逃脫"抗體"綑綁
和 SARS-CoV-1 帶電相比,SARS-CoV-2 有增強的正電荷群 , 能黏上 帶負電荷的 硫酸乙酰肝素蛋白聚醣HSPGs,與之結合,獨立於結合Spike棘蛋白ACE2受體的模式 ,利於 SARS-CoV-2 黏上人類細胞 , 以雙重結合模式去感染人類細胞。

造成了"突破性感染"
液遞免疫, 釋放到細胞外液的『抗體』會被逃脫 , 當然病毒能一次又一次侵入到細胞內 ,所以病毒一定會突破人體阻絕境外的抗體, 一定會跑進來 , 造成感染數目一定會很高
而且感染後還會再次被感染
液遞免疫的抗體無法阻絕病毒於細胞外,會不斷的重複感染, 最終才被細胞免疫的T細胞清除掉
由過去武漢病毒研究所 發表過的論文有那些 ?
2012 就做出引發雲南墨江礦工白肺的 類SARS病毒的全基因序列
法國世界報 , 批漏了 石正麗 指導的研究生 的三篇論文
https://www.rfi.fr/cn/中国/20210527-covid-19溯源-武汉病毒研究所未发表的三篇论文遭披露-事故假设被重提
第一篇

其中一位喻萍的碩士論文,「蝙蝠SARS樣冠狀病毒的地理進化研究」研究了當時2012年,從雲南墨江通關鎮這個地方,所分離的一些病毒株。她實際上有對四個病毒株,來自雲南墨江的病毒株進行全基因組的測序,這個在石正麗的所有的文章中,沒有這麼完整的說明過。
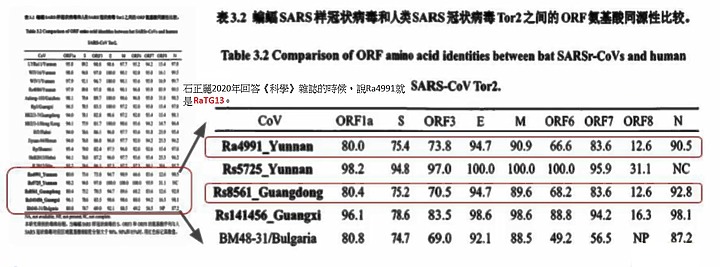
石正麗在2020年回答《科學》雜誌的時候,她說Ra4991就是RaTG13。可是這一次《世界報》,比較研究生論文發表出來的序列,和RaTG13這二個序列之後,發現一個非常有意思的事情,二者用來感染人的那部分的這種蛋白,差異有多大,1%~1.5%,科學家解釋這樣的差異需要進行十次到十五次的變異才能達到這樣的變化,可是石正麗親口講,這二個是同一個病毒? 在實驗室內都沒有"繼代"過嗎 ?
早在 2008 年 , 武漢病毒實驗室早就做出"嵌合病毒"
第二篇 武漢病毒實驗室早就具有 改變病毒S蛋白 去嵌合 ACE2 受體的能力
如果這個野生病毒株沒有接合 ACE2 受體的能力 ? 那就給它一個 ACE2受體能結合的蛋白
2008年Wuze Ren等人在病毒學期刊上, 成功展示了在蝙蝠 SARS 樣病毒和人類 SARS 病毒之間交換 RBD 的技術能力:“......
發現最小插入區(氨基酸 310 至 518)足以將 SL-CoV S 從非 ACE2 結合轉化為與人類 ACE2 結合,表明 SL-CoV S 與 SARS-CoV S 在很大程度上兼容蛋白質的結構和功能。
J Virol. 2008 Feb; 82(4): 1899–1907.
Difference in Receptor Usage between Severe Acute Respiratory Syndrome (SARS) Coronavirus and SARS-Like Coronavirus of Bat Origin▿
(Wuze Ren , 等人,中國科學院武漢病毒研究所2008 年)。
Wuze Ren,中文 : 任武澤,中國科學院武漢病毒研究所石正麗研究員2004~2007年指導的博士研究生,曾獲2007年中國科學院院長獎學金優秀獎、湖北省優秀博士學位論文獎。
2008年石正麗的博士生任武澤 , 成功展示了在蝙蝠 SARS 樣病毒和人類 SARS 病毒之間交換 RBD 的技術能力:“......
發現最小插入區(氨基酸 310 至 518)足以將 SL-CoV S 從非 ACE2 結合轉化為與人類 ACE2 結合,表明 SL-CoV S 與 SARS-CoV S 在很大程度上兼容蛋白質的結構和功能。
2017年 做出的嵌合病毒 , 有 Rs4231、Rs4874、Rs7327和RsSHC014 這株四病毒
法國世界報批漏 这三篇论文中,2017年的博士论文「蝙蝠SARS樣冠狀病毒的反向遺傳學系統的建立及ORFX功能研究」最顶尖;它利用了嵌合病毒构建技术,即一种 "复制粘贴"的方式。中国研究人员的目标之一是测试不同冠状病毒对几种类型的人类或动物细胞的感染性,而这取决于嫁接在同一病毒骨架上的「編碼基因」。

论文作者曾磊平写道:"为了估计类似SARS的蝙蝠冠状病毒对人类的潜在威胁,我们从不同的冠状病毒毒株中选择了12个S(即尖峰编码)基因,并将它们插入WIV1(另一种冠状病毒)的基因组框架中,作者说,"我们成功地获取了其中四个,分别将其命名为Rs4231、Rs4874、Rs7327和RsSHC014病毒株。"
石正麗的實驗室已經展示, 任何冠狀病毒都能換上 RBD 區的編碼 ,就有ACE2的強結合 ?
有?或是沒有 ACE2結合力 ? 完全都是可以在實驗室內"複製貼上" , 是完全可以自行控制的, 不必天然病毒
SHC014 又出現了 ?
再對照回到 石正麗於 2015年 發表於 Nature的重組嵌合病毒(稱為 SHC014--MA15)?
石正麗博士與北卡羅來納大學著名的冠狀病毒研究人員拉爾夫·S·巴里克 (Ralph S. Baric) 合作。他們的工作重點是增強蝙蝠病毒攻擊人類的能力,以“檢查正在傳播的蝙蝠 CoV [冠狀病毒] 的出現潛力(即感染人類的潛力)。”
為實現這一目標,他們於 2015 年 11 月創造了一種新型病毒,採用 SARS1 病毒的骨架並將其刺突蛋白替換為來自蝙蝠病毒(稱為 SHC014-CoV)的刺突蛋白。這種人造病毒能夠感染人類呼吸道的細胞,至少在針對此類細胞的實驗室培養物進行測試時是如此。
Nature Medicine 的這一篇報告 , 就提到它們還有 編碼新型,人畜共患的冠狀病毒刺突蛋白的嵌合病毒-(SHC014-MA15)
《A SARS-like cluster of circulating bat coronaviruses shows potential for human emergence》

新的人畜共通的的嵌合病毒 (SHC014-MA15)是將SARS病毒的刺突蛋白 ,替換為來自蝙蝠病毒(稱為 SHC014-CoV)的刺突蛋白 ?
對照曾磊平的論文 , 是將基因(即尖峰编码)插入WIV1(另一种冠状病毒)的基因组框架中 ? 去得到 SHC014 ?
原本以為是 天然蝙蝠病毒的 SHC014-CoV ? 卻是曾磊平选择了12个S(即尖峰编码)基因,并将它们插入WIV1另一种冠状病毒, 所變出來的實驗室嵌合病毒?
石正麗 拿了這種嵌合病毒 SHC014-CoV 再去和SARS嵌合? 再變出 (SHC014-MA15)人畜共通的的嵌合病毒 ?
(4)對蝙輻細胞的感染力弱? 親和力只有對人類細胞的1/10
如果是從蝙輻來的病毒 ,應該很擅長感染蝙輻 , 但是香港做了實驗 ,13種蝙輻當中,只有2種蝙輻能被感染?
且感染力不強 , 只有感染人的 1/10 ? 對人類細胞的感染力最強 !
因為 RBD 區的編碼被換了
(5)找不到中間宿主 ?
這些特徵根本就不是以往自然演化出現的冠狀病毒 , 而是雲南的RaTG13病毒的骨幹+廣東MP789的RBD區+PRRA的插入, 表現出『嵌合病毒』的特徵
內文搜尋
X





























































































