Amanda L. Renzi:What is the difference between Ropeginterferon and Pegasys?
羅氏干擾素與藥華藥新一代干擾素P1101 有何不同?
Kevin Walsh It's my understanding that Ropeg is only administered every other week or late one is monthly. I believe it's just a different form of interferon, but I may be wrong but I think the main difference is the middle aspect of it. Personally, if Pegasys is working well for me, I'm not sure I would change meds unless I had to.
據我所知,藥華藥新一代干擾素P1101 是每兩周或每月注射一次。我相信它只是一種不同形式的干擾素,也許我的理解有誤,我認為他主要區別在於它的鏈結。以我而言,如果羅氏干擾素Pegasys對我來說效果很好,除非有必要否則我不會更換藥物。
Dennis Zabel:Pegasys is an a2a interferon where Ropeg is an a2b interferon. I do not think there is much of a difference between alpha and bravo versions. What is different is the pegylation process which allows one injection to last for 14 days as opposed to seven. Based upon ongoing clinical trials ROPEG has been shown to have less side effects than PEG and has been shown to be superior to HU on all fronts.
羅氏干擾素Pegasys是干擾素a2a,藥華藥新一代干擾素P1101是a2b干擾素。我不認為兩者之間存在太大差異。差別在於藥華藥新一代干擾素P1101療效持續14天而非7天。基於目前的臨床數據,藥華藥新一代干擾素P1101已經顯示出比羅氏干擾素Pegasys更少的副作用,並且顯示在所有方面都優於HU。
Pia Hartvigsen Hi Dennis, do you have any links to research that documents less sideeffects with Ropeg? Im interested as i might start one of them soon
Dennis, 你有任何提到到藥華藥新一代干擾素P1101副作用比較少的連結嗎?我有興趣是因為我很快可能就會在其中一種藥物中開始進行治療
Jill Zaitchick Pia Hartvigsen --Ropeg is not yet available in the USA--only in Europe.
Pia Hartvigsen,藥華藥新一代干擾素P1101還無法在美國使用,只能在歐洲
Amanda L. Renzi Jill Zaitchick I wonder why that is.
Jill, 為什麼?
Dennis Zabel Pia Hartvigsen I will look tomorrow to see if I can find the link. I heard MPN specialist Dr Gisslinger from Austria present the findings last year at a conference. They were also presented at ASH in 2018.
我明天看看能否找到相關連結。我聽說來自奧地利的血液權威Gisslinger博士去年在一次會議上簡報了相關成果。他們也於2018年美國血液年會簡報。
David Katz Amanda L. Renzi the FDA is extremely rough. Always has been. That’s something that President Trump has been fighting. He believes that cancer drugs should not be regulated because it cannot hurt relative to the nature of the diseases themselves. Trump believes that these FDA restrictions are wasting valuable time for cancer patients. Hopefully, he makes some headway.
FDA一直都很糟糕。這是川普總統一直在反對的事,他認為不應該對抗癌藥物進行監管,這些藥物不會對疾病本身造成傷害。川普認為,這些 FDA 限制正在浪費癌症病患的寶貴時間。希望他能有一些進展。
Pia Hartvigsen Jill i know, im in Europe
Jill, 我知道, 我人在歐洲

法國血液學權威醫生Dr Jean Jacques Kiladjian演講主題:「臨床終點與治療目標上在骨髓增生性腫瘤(MPNs)的探討。」
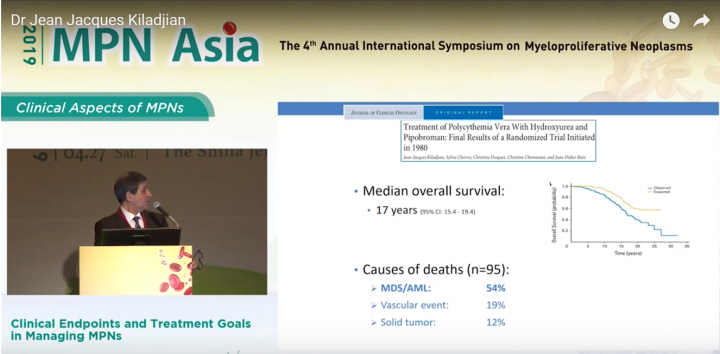
1980年一項隨機針對PV病患隨機採用HU以及Pipobroman進行治療的追蹤成果顯示, 在平均中位數17年的治療期間, 病患死亡於骨髓化生不良症候群(MDS)以及血癌(AML)的病患高達54%, 而死於血栓的比例僅為19%, 12%為惡性腫瘤。從此數據看來, 病患在長期使用這些藥物情況下, 有很大的機會會惡化成血癌, 因此在年輕的病患提供該藥時需要更加謹慎。

該簡報檔顯示出, 整體病患在使用 HU/Pipobroman 於10年期的療程追蹤後, 疾病惡化成骨髓化生不良症候群(MDS)以及血癌(AML)的病患比例為9.8%, 而在15年的療程追蹤期下, 惡化比例會上升到24%;20年的療程追蹤期下, 惡化的比例會攀升至34%。
由於Pipobroman現在僅有法國能提供用藥,因此若單純只比較HU組, 10年期的療程時間, 病患惡化成骨髓化生不良症候群(MDS)以及血癌(AML)的病患為7.3%, 而15年的療程期間, 惡化的比例會升到11%;20年的療程期間下, 惡化的比例會攀升至17%;這代表使用HU進行治療下, 病患仍有很高的風險惡化成血癌。

而目前在PROUD-PV/CONTI-PV臨床成果, 平均3.8年的療程時間下, 藥華藥新一代長效型干擾素P1101實驗組, 並未發現任何惡化成血癌的案例;而對照組HU則是發生兩例, 我們期盼這個藥在長期追蹤下, 能降低病人惡化成血癌風險。
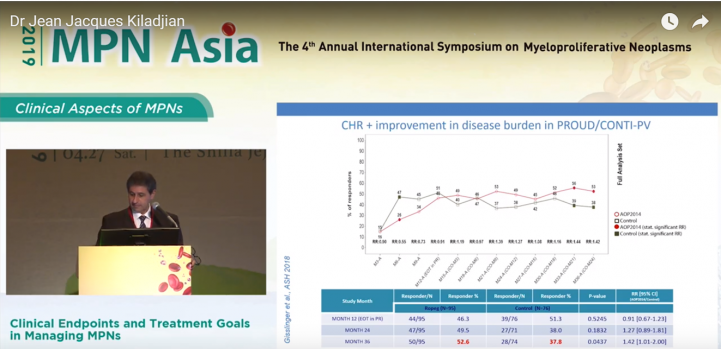
在PROUD-PV/CONTI-PV臨床結果可以發現, 在病患36個月的療程後, P1101組不管在療效部分血球數量的控制以及疾病控制上, 數據均顯著優於對照組HU。

在PV的臨床上, 我們需要觀察以下三項指標:
# 避免血管栓塞事件
# 最小化病患惡化為血癌風險
# 管理疾病症狀
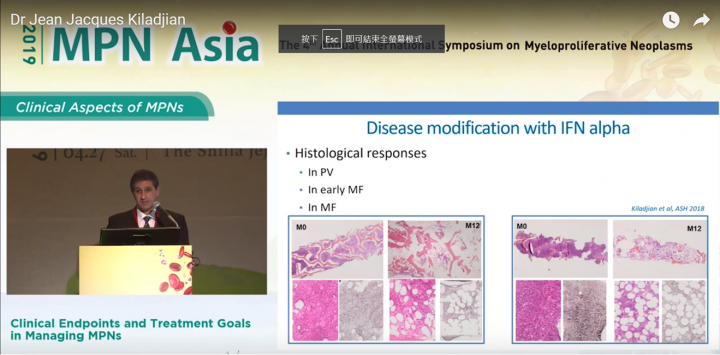
而我們發現, 干擾素在PV/早期MF/以及MF適應症中, 均發現能產生疾病修復的組織反應。
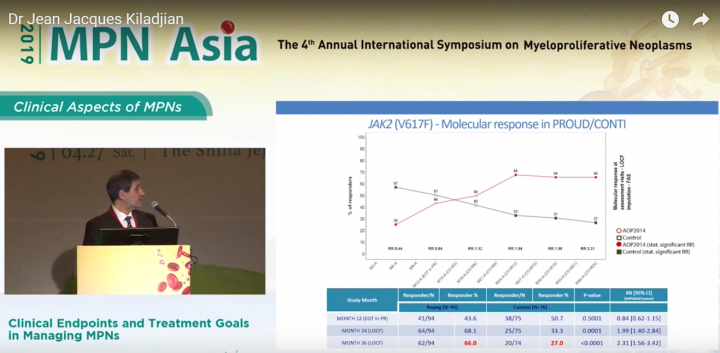
在此簡報中可以看到, PROUD-PV/CONTI-PV臨床結果顯示, 在36個月的治療期間, 藥華藥新一代長效型干擾素P1101實驗組分子反應為66%, 而HU組僅為27%。
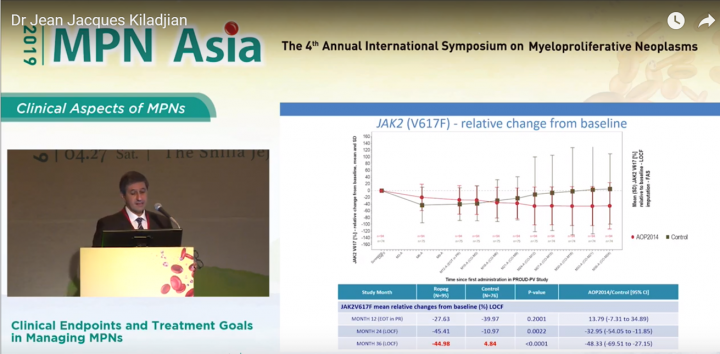
PROUD-PV/CONTI-PV臨床結果顯示, 在36個月的治療期間, 藥華藥新一代長效型干擾素P1101實驗組JAK2平均值由基準值下降近45%, 而HU組在JAK2突變值反而較基準值增加近5%。
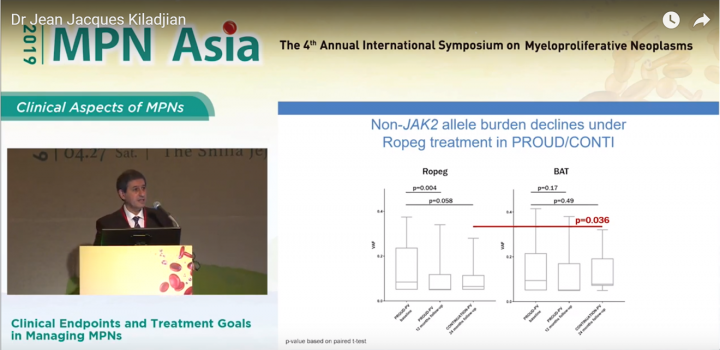
此外, 從此簡報中可以看出, 藥華藥新一代長效型干擾素P1101實驗組比起對照組HU亦能夠看出P1101組在降低病患JAK2以外的突變數量上亦能夠有明顯成效。
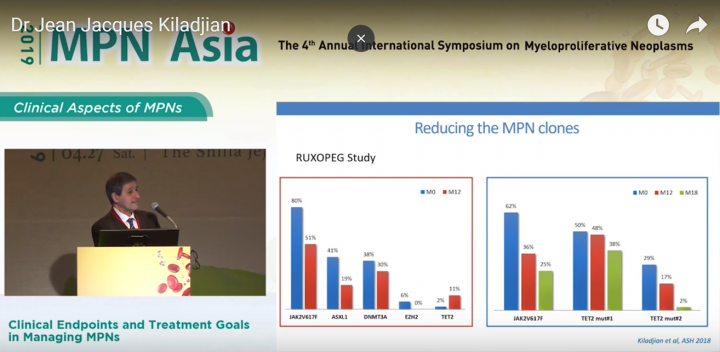
本簡報顯示, 藍色為初期的病患各項突變比率, 紅色為治療期間12個月的病患突變比率, 綠色為治療期間18個月的病患突變比率。圖表中可看出, JAK2突變、ASXL1突變以及DNMT3A、EZH2突變值均在病患使用P1101進行治療後降低, 而TET2突變則是需要長期進行干擾素治療才能產生效果, 如右圖, 病患在長期使用干擾素進行治療後, TET2突變比率仍顯著降低。
明天留起來慢慢看。
送你5分。
AlanLiu0508 wrote:
(6446) 藥華...(恕刪)
請多多點擊 Mobile01 網站內的贊助商廣告,有贊助商的支持才有穩定的Server和快速頻寬。
www.pharmaessentia.com/uploads/images/20190604_%E6%9C%89%E9%97%9C%E6%8A%95%E8%B3%87%E4%BA%BA%E8%BF%91%E6%97%A5%E9%97%9C%E6%B3%A8%E7%9A%84%E8%AD%B0%E9%A1%8C%E4%B9%8B%E5%95%8F%E8%88%87%E7%AD%94Part3.pdf
1) 歐盟出貨進度?
5 月底已按 AOP 定貨要求,將藥品出貨給 AOP 公司,營收係屬重大事件,將依規定公告於公開觀測資訊站。
2) 美國藥證申請進度?
目前已積極投入 pre-BLA 會議資料 (Briefing Booklet)的準備,pre-BLA 的會議係屬於 FDA 重大會議,其各部門代表一般均會與會。
因最近適逢美國暑期度假期,美國子公司同仁已經與 FDA 預排會議時程,一旦會議時間確定,將立即於官網公告會議日期。此會議為非常關鍵的會議,本公司同仁必定全力以赴。
3) 日本藥證申請進度?
由日本子公司同仁積極推展的第一期臨床試驗已在本月順利完成,目前正在整理數據。另按原本的規劃,日本子公司已於 5 月 28 日與 PMDA 進行諮詢會議。在本次會議中,PMDA 再度確認以歐洲的 PROUD/CONTI 臨床試驗結果作為 pivotal trial 數據是可以接受的;而必須在日本病患執行的 「類第二期單臂小型有效性、安全性」的臨床試驗,本公司與 PMDA 也取得非常好的共識。有關該臨床設計的細節,PMDA 表明希望再開一次諮詢會議來討論,以便盡快進行正式的面對面會議討論並定案。
4) 中國藥證申請進度?
在北京佑安醫院進行的第一期臨床試驗「劑量爬升試驗」,第二劑量收案已完成,將在確認安全無虞後即可爬升到第三劑量的收案。下次與 CFDA 非正式的諮詢會議重點將針對 「類第二期單臂小型有效性、安全性」的臨床試驗設計進行討論。
5) 臺灣藥證申請進度?
台灣藥證申請將依台中針劑廠的進度來決定,目前台中針劑廠的三批確效已經順利完成,待取得一個月的產品安定性數據後即可準備向主管機關提出BLA 送件。台中針劑廠的 GMP/GDP 認證,將在 BLA 送件後,以商業化認證方式申請。
https://finance.yahoo.com/news/athenex-rallies-positive-early-data-220610507.html
Athenex Rallies on Positive Early Data on Psoriasis Candidate
Athenex 針對牛皮癬病患發表早期正面數據
June 11, 2019
2019年6月11日
Athenex, Inc. ATNX along with Taiwan’s PharmaEssentia Corp announced positive preliminary data from a phase I study on its pipeline candidate, KX2-391 (tirbanibulin) ointment. Positive early clinical signals were observed in a small cohort of patients with psoriasis, having undergone treatment with the ointment in a phase I study.
Athenex公司和台灣的藥華醫藥公司共同發表了早期KX2-391軟膏於臨床一期研究的初期數據。在臨床一期試驗中在一小群牛皮癬病患者用軟膏治療後中觀察到正面的臨床信號。
The World Health Organization has suggested tirbanibulin as the International Nonproprietary Name (INN) for KX2-391.
世界衛生組織建議將KX2-391在國際非專利藥品名稱(INN)上取名為tirbanibulin。
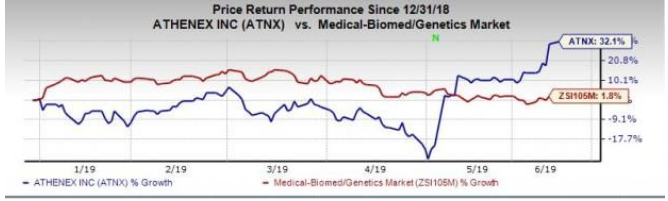
Shares of Athenex were up almost 10.5% following this news on Friday. In fact, the stock has surged 32.1% so far this year outperforming the industry’s increase of 1.8%.
週五發布此訊息後,Athenex股價上漲了近10.5%。事實上,今年到目前為止,該股票上漲32.1%,超過了該產業1.8%的漲幅。
In the study, six patients were examined with a mild to moderate psoriasis. All the subjects in the cohort, treated with KX2-391 1% ointment — once daily for 5 days — experienced some kind of an improvement. While one of them had a complete resolution of skin scaling, another, experienced better psoriatic plaque thickness. Overall, KX2-391 was well-tolerated with no serious adverse events reported.
在該研究中,六名病患被檢查中輕至中度的牛皮癬。用KX2-391 1%的軟膏治療病患,在持續五天每天一次的治療中,均取得了某種程度的改善。其中一位徹底解決皮膚脫屑問題,而另一位,雖然其中一個具有完全分辨皮膚鱗屑,另一個則是乾癬改善。整體而言,KX2-391對病患的耐受性良好,並未發現嚴重的不良反應。
Both companies are working to evaluate the optimal treatment regimen for psoriasis with KX2-391.
兩家公司都在努力評估KX2-391用於牛皮癬治療的最佳治療方案。
KX2-391 ointment is currently being developed in late-stage studies for treating actinic keratosis (AK) — a crusty, scaly growth caused by damage from exposure to ultraviolet radiation. Earlier this year, Athenex presented positive top-line safety and efficacy data from the two phase III studies on KX2-391 for addressing AK at the annual meeting of American Academy of Dermatology. The product was well tolerated by the enrolled patient population.
KX2-391軟膏目前正在用於治療日光性角化症(AK)的晚期研究,這是一種暴露於紫外線輻射造成的損傷引起的硬皮。今年早前,Athenex在美國皮膚病學會年會上(American Academy of Dermatology)就KX2-391的兩項臨床三期研究中提出了正面臨床試驗安全性和有效性數據。登記的病患群中對該產品均具有良好的耐受性。
We would like to remind investors that PharmaEssentia in-licensed rights to KX2-391 from Athenex for treating psoriasis and non-malignant skin conditions (excluding actinic keratosis) in Mainland China, Taiwan, Hong Kong, Macau, Singapore and Malaysia along with the rights for treating AK across Taiwan.
投資者可以了解到;藥華醫藥公司PharmaEssentia從Athenex公司取得KX2-391用於治療中國大陸、台灣、香港、澳門、新加坡和馬來西亞地區牛皮癬和非惡性皮膚病(不包括日光性角化症)的銷售權利以及台灣地區用於治療日光性角化症的銷售權利。
In a separate press release, Athenex announced that its active pharmaceutical ingredient (API) plant in Chongqing, China has been voluntarily suspended with respect to all production activities. The company expects to have a resolution by the end of third-quarter 2019, subject to inspection and evaluation by the Department of Emergency Management of Chongqing.
在另一份新聞稿中,Athenex宣布其在中國重慶的API工廠已暫停。該公司預計將在2019年Q3之前通過重慶市緊急事務管理部門的檢查和評估。
Athenex currently carries a Zacks Rank #3 (Hold). Better-ranked stocks in the healthcare sector include Acorda Therapeutics, Inc. ACOR, Repligen Corp. RGEN and Merus N.V. MRUS, all sporting a Zacks Rank #1 (Strong Buy). You can see the complete list of today’s Zacks #1 Rank stocks here.
Zacks目前評價Athenex為等級3(持有)。
發言日期: 108/06/18 19:35:41
1.事實發生日:108/06/18
2.公司名稱:藥華醫藥股份有限公司
3.與公司關係(請輸入本公司或子公司):本公司
4.相互持股比例:不適用
5.發生緣由:
本公司 Ropeginterferon alfa-2b ( P1101 )供查驗登記用藥品臨床試驗計畫,已獲中國國家藥品監督管理局同意按照提交的方案開展乙型肝炎e抗原陽性慢性乙型肝炎的臨床試驗。
方案號:A18-302,版本:fv 2.0。
6.因應措施:發布本重大訊息
7.其他應敘明事項:
(1)研發新藥名稱或代號:Ropeginterferon alfa-2b ( P1101 )
(2)用途:治療慢性B型肝炎e抗原陽性患者,並以B型肝炎的核心抗體(Hepatitis B core antibody (Anti-HBc))作為生物標誌(biomarker) 篩選對干擾素治療最有療效的族群加以治療。
(3)預計進行之所有研發階段:進行三期臨床試驗及未來新藥查驗登記。
(4)目前進行中之研發階段:
(一)提出申請/通過核准/不通過核准/各期人體臨床試驗 (含期中分析)結果/發生其他影響新藥研發之重大事件:
本公司Ropeginterferon alfa-2b ( P1101 ) 供查驗登記用藥品臨床試驗計畫,已獲中國國家藥品監督管理局同意按照提交的方案開展乙型肝炎e抗原陽性慢性乙型肝炎的臨床試驗。
(二)未通過目的事業主管機關許可、各期人體臨床試驗(含期中分析)結果未達統計上顯著意義或發生其他影響新藥研發之重大事件者,公司所面臨之風險及因應措施:不適用
(三)已通過目的事業主管機關許可、各期人體臨床試驗(含期中分析)結果達統計上顯著意義或發生其他影響新藥研發之重大事件者,未來經營方向:不適用
(四)已投入之累積研發費用:考量未來市場行銷策略,保障公司及投資人權益,暫不公開揭露。
(5)將再進行之下一研發階段:
A.預計完成時間:預計2~3年完成,惟實際時程將依執行進度調整。
B.預計應負擔之義務:無。
(6)市場現況:
B型肝炎是世界上最流行的感染性疾病之一。據世界衛生組織估計,全世界B型肝炎帶原者約有4億人口,每年約有100萬人死於B型肝炎及相關疾病;每年全世界新增B型肝炎人口約為1000萬至3000萬人,這些人之中約有5~10%會成為帶原者,帶原者中約有30%的病人具有高含量的B型肝炎核心抗體。
據醫學文獻報導,這類具有高含量的B型肝炎核心抗體族群對干擾素的治療效果最好,因此本臨床試驗將以這類族群為治療標的。目前被核准用於治療慢性B型肝炎的藥物為小分子核甘(酸)類抗病毒藥 (Nuc)及干擾素例如 pegylated interferon ,惟前者僅能抑制病毒無法治癒,但後者治癒率亦不高。因此本試驗用B型肝炎核心抗體作為生物標誌,篩選出對干擾素治療最有療效的病人加以治療,提高干擾素的治癒率,期使病患及醫師將來會以 Ropeginterferon 為治療該類病人的首選,達到個體化用藥 (personalized medicine) 的目標。
(7)新藥開發時程長、投入經費高且並未保證能一定成功,此等可能使投資面臨風險,投資人應審慎判斷謹慎投資。
2019.06.27
https://mops.twse.com.tw/nas/STR/644620190627M001.pdf
2019/ 7/ 2
www.pharmaessentia.com/uploads/images/20190702%20%E5%AE%98%E7%B6%B2Q&A-%E6%9C%89%E9%97%9C%E8%BF%91%E6%97%A5%E6%8A%95%E8%B3%87%E4%BA%BA%E9%97%9C%E6%B3%A8%E4%B9%8B%E5%95%8F%E8%88%87%E7%AD%94%20Part%204.pdf
1) 公司 3 月份和 5 月份有出貨,因為公司營收是以出貨認列,請問年底以前還會出貨嗎?
答: 會的,年底前會出貨。
本公司上半年的出貨量是 AOP 初估其在德、奧下半年的需求量。有關年底的出貨的部分,在公司官網 5/20 問答集 〈有關投資人近日關注的議題之問與答〉提到下半年的訂單已經接到。基於 AOP 要求我們年底以前一次性出貨,公司遂與德國 Vetter 針劑代工廠安排充填的時程。Vetter 已經配合安排好產線於年底以前一次充填完畢後,再進行所有的品管品保程序即可出貨。AOP下半年訂的量較上半年多。
本公司和 AOP 的業務往來目前採接單式的生產及出貨,這和國內其他生技公司每月出貨每月認列營收的情形是完全不一樣的。
2) 據報導本年度國際生技大會 (2019 BIO International Convention),藥華醫藥歷年都有參加,今年也應該不例外。請問今年有什麼收穫?
答: 公司在 BIO Convention 中獲得全球生技公司,尤其是經銷商的關注,有很多要求與我們公司進行一對一洽談 (One-on-One Partnering)。原因來自於今年 2 月份我們的創新藥 Besremi 被 EMA (European Medicines Agency) 授予行銷藥證,是 EMA 今年所授予的第三個新藥藥證,遂引起全球生物科技界廣泛注意。根據 EMA 網站,截至今年五月底,EMA 僅核准 14 個新藥藥證,而我們已成為其中之一員。
資料來源: Table of all EPARs for human and veterinary medicines (link) 經公司評估結果,選擇能夠協助為優先可能合作的夥伴。此次會議對象精選來自加拿大、中南美洲、澳洲及東南亞等區域的經銷商。公司亦於會後持續洽商中,未來如有進一步消息,將會在公司官網公佈分享。
本公司為拓展全球市場行銷規劃,已在美國、日本、中國自建營運團隊、佈局行銷,另韓國及台灣正積極著手進行中。
內文搜尋
X





























































































