https://www.youtube.com/watch?v=7EjnHGP0glk&feature=youtu.be&t=2347
其中一項提問為:長期使用P1101看起來很好, 請問專家們會建議PV病患立刻使用P1101取代 HU 進行治療嗎?
Dr. Kiladlian:
PROUD-PV 臨床試驗大多是在未經治療的病患, 雖然有1/3的病患先前用過HU治療。研究顯示出一年期臨床結果兩者療效相同, 但兩年期的試驗結果顯示, 包含在血液學反應的療效持續性以及分子反應的反應率提升上, 都顯示干擾素療效比HU更佳, 所以根據上述資料顯示, 我會回答 "是", 我傾向開始使用新一代長效型干擾素P1101作為一線用藥, 而維持 HU 為二線用藥。
Dr. Srdan: 我認同
Dr. Silver: 我認同
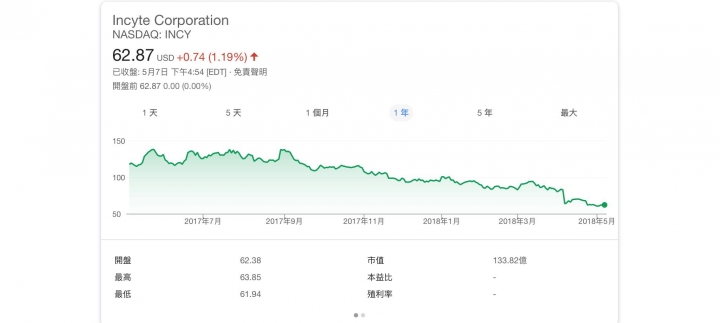
Incyte癌藥臨床失敗 股挫
據瑞士信貸 2016年 Incyte 評價報告指出,

# Jakafi 推算出 每股價值為 43元
# Epacadostat 推算出每股價格為 26元。
來源於連結 Page.6 處:
Incyte Corporation (INCY) - Research & Analytics - Credit Suisse
在Incyte 臨床三期試驗失敗後, 瑞士信貸提出 移除Incyte中 Epacadostat 的評價, 目標價下修至 78元。
Incyte (INCY) PT Lowered to $78 at Credit Suisse, 'Removing epacadostat from our valuation'
https://m.cnyes.com/news/id/4120573
(越接近開獎時間心情真的十分忐忑
 )
)照片中紅線標記
有大大可以預估大概需要多久的時間呢?
看到了~預計今年年底就可以完成了






2018-05-11 08:56
https://udn.com/news/story/7254/3136047
經濟日報 記者黃淑惠╱即時報導
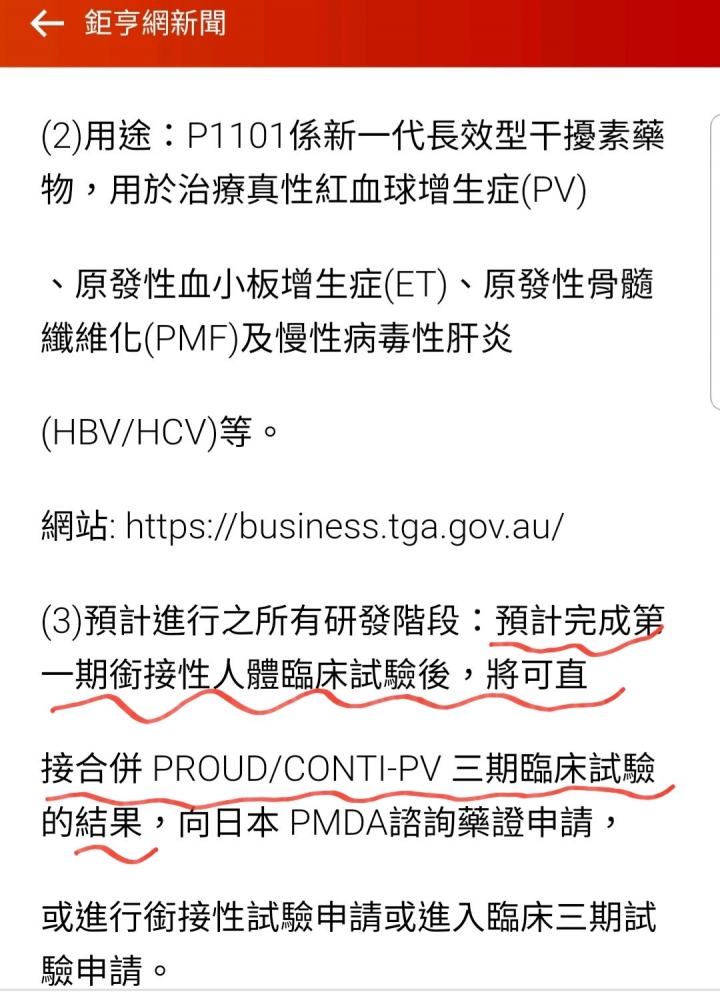
藥華醫藥(6446)自主研發的創新生物新藥 P1101 將由藥華藥日本子公司啟動在日本橋接臨床試驗,試驗目的是將比較出日本人與白種人在藥物動力與藥效動力(PK/PD)的相似性,以為向日本藥監局 (PMDA)申請藥證的第一步。該臨床試驗將於 5 月起收第一個受試者,完成後將可直接合併 PROUD/CONTI-PV 三期臨床試驗的結果,向日本 PMDA諮詢藥證申請,或申請進行銜接性試驗或進入臨床三期試驗。事實上在日本進行 P1101 的臨床試驗所得資料將會幫助日本醫界及病患在血液疾病及病毒感染疾病治療的最新發展。
本次 P1101在日本的橋接臨床試驗已委託 IQVIA(前Quintiles)於澳大利亞執行,採用逐步劑量增加的設計,將分成四組施予不同劑量,分別為100ug、200 ug、300 ug、450 ug,每組受試者均為日本人與白種人各6人,共將收48人,給藥後將持續追蹤受試者35天,評估指標在了解藥物安全性、耐受性與藥物動力學參數,主要目的在比較日本人與白種人在藥物動力與藥效動力(PK/PD)的相似性。本公司已於今日收到CRO(IQVIA)通知日本子公司由澳洲TGA(Therapeutic Goods Administration)臨床核准許可。
目前在日本約有2萬名紅血球增生症(PV)病患,有就診並經醫院所診斷的確診病患約為1.4萬名,其中有接受藥物治療的患者1.2萬名,約占確診病例數86.4%,占罹病數的60.5%。根據Sonet M3 survey統計,接受藥物治療的1.21萬名PV患者,有53%是服用HU(Hydroxyurea)、36%使用Aspirin mono、11%使用Ruxolitinib(Jakavi)治療;而日本估有3.1萬名血小板增多症(ET)病患,有就診並經醫院所診斷的確診病患約2萬名,其中高危險全患者1.18萬名,約占確診病例數的59%,根據Tracking Survey統計約有9成高風險患者有接受藥物治療,其中60%是服用HU、20%使用Anagrelide(安威靈)、19%使用Aspirin mono治療。
內文搜尋
X